Modernes PRP: „Klinisches PRP“
In den letzten 10 Jahren hat sich das Behandlungsschema der PRP stark verändert.Durch experimentelle und klinische Forschung haben wir jetzt ein besseres Verständnis der Blutplättchen- und anderen Zellphysiologie.Darüber hinaus haben mehrere hochwertige systematische Auswertungen, Metaanalysen und randomisierte kontrollierte Studien die Wirksamkeit der PRP-Biotechnologie in vielen medizinischen Bereichen gezeigt, darunter Dermatologie, Herzchirurgie, plastische Chirurgie, orthopädische Chirurgie, Schmerztherapie, Wirbelsäulenerkrankungen und Sportmedizin .
Das aktuelle Merkmal von PRP ist seine absolute Blutplättchenkonzentration, die sich von der ursprünglichen Definition von PRP (einschließlich Blutplättchenkonzentration über dem Ausgangswert) auf mehr als 1 × 10 6/µL oder etwa das Fünffache der minimalen Blutplättchenkonzentration in Blutplättchen ändert Grundlinie.In der ausführlichen Übersicht von Fadadu et al.33 PRP-Systeme und -Protokolle wurden evaluiert.Die Thrombozytenzahl des von einigen dieser Systeme hergestellten PRP-Endpräparats ist niedriger als die des Vollbluts.Sie berichteten, dass der Thrombozytenfaktor von PRP mit dem Single-Spin-Kit (Selphyl®) auf nur 0,52 anstieg.Im Gegensatz dazu ist die vom Gerät erzeugte Thrombozytenkonzentration beim EmCyte Genesis PurePRPII ® mit Doppelrotation am höchsten (1,6 × 10 6 /µL).
Offensichtlich sind In-vitro- und Tiermethoden nicht die ideale Forschungsumgebung für eine erfolgreiche Umsetzung in die klinische Praxis.Auch die Gerätevergleichsstudie unterstützt die Entscheidung nicht, da sie zeigt, dass die Thrombozytenkonzentration zwischen PRP-Geräten sehr unterschiedlich ist.Glücklicherweise können wir durch auf Proteomik basierende Technologie und Analyse unser Verständnis der Zellfunktionen bei PRP verbessern, die sich auf die Behandlungsergebnisse auswirken.Bevor ein Konsens über standardisierte PRP-Präparate und -Formulierungen erzielt wird, sollte PRP den klinischen PRP-Formulierungen folgen, um wesentliche Gewebereparaturmechanismen und progressive klinische Ergebnisse zu fördern.
Klinische PRP-Formel
Derzeit ist wirksames klinisches PRP (C-PRP) als eine komplexe Zusammensetzung autologer multizellulärer Komponenten in kleinem Plasmavolumen charakterisiert, das nach Zentrifugation aus einem Teil des peripheren Bluts gewonnen wird.Nach der Zentrifugation können PRP und seine Nicht-Blutplättchen-Zellbestandteile entsprechend unterschiedlicher Zelldichten (von denen die Blutplättchendichte die niedrigste ist) aus dem Konzentrationsgerät gewonnen werden.
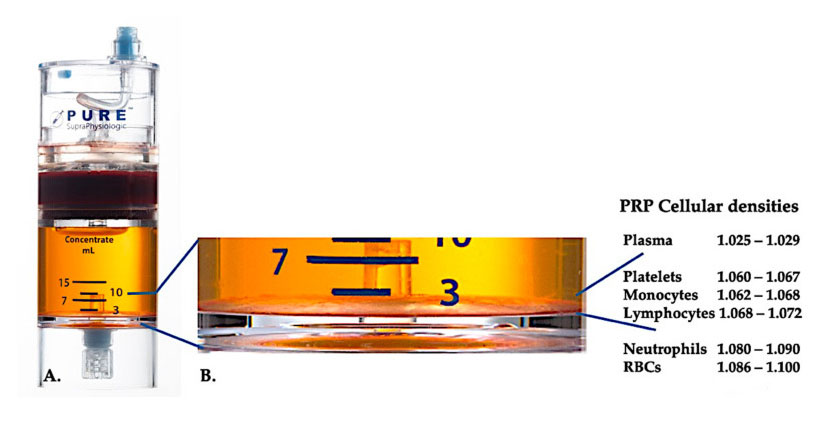
Für Vollblut wurde nach zwei Zentrifugationsverfahren das PurePRP-SP®-Gerät zur Zelldichtetrennung (EmCyte Corporation, Fort Myers, FL, USA) verwendet.Nach dem ersten Zentrifugationsprozess wurde die Vollblutkomponente in zwei Grundschichten getrennt: die Blutplättchen-Plasmasuspension (mager) und die Schicht der roten Blutkörperchen.In A ist der zweite Zentrifugationsschritt abgeschlossen.Das tatsächliche PRP-Volumen kann für die Anwendung am Patienten extrahiert werden.Die Vergrößerung in B zeigt, dass sich am Boden des Geräts eine organisierte braune Schicht aus Erythrozytensedimentation aus mehreren Komponenten (dargestellt durch die blaue Linie) befindet, die basierend auf dem Dichtegradienten hohe Konzentrationen an Blutplättchen, Monozyten und Lymphozyten enthält.In diesem Beispiel wird gemäß dem C-PRP-Vorbereitungsprotokoll mit schlechten Neutrophilen der minimale Prozentsatz an Neutrophilen (<0,3 %) und Erythrozyten (<0,1 %) extrahiert.
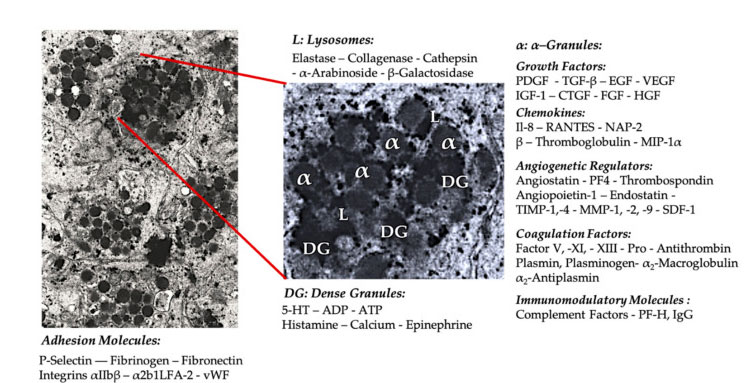
Blutplättchengranulat
In der frühen klinischen PRP-Anwendung sind α-Granulat die am häufigsten genannte innere Struktur von Blutplättchen, da sie Gerinnungsfaktoren, eine große Anzahl an PDGF und angiogenen Regulatoren enthalten, aber nur eine geringe thrombogene Funktion haben.Zu den weiteren Faktoren zählen weniger bekannte Chemokin- und Zytokinkomponenten wie der Plättchenfaktor 4 (PF4), das präplättchenbasische Protein, P-Selectin (ein Aktivator von Integrin) und das Chemokin RANTES (reguliert durch Aktivierung, das normale T-Zellen exprimiert und vermutlich Sekretion).Die Gesamtfunktion dieser spezifischen Blutplättchengranulatkomponenten besteht darin, andere Immunzellen zu rekrutieren und zu aktivieren oder eine Entzündung der Endothelzellen auszulösen.
Dichte granuläre Komponenten wie ADP, Serotonin, Polyphosphat, Histamin und Adrenalin werden eher implizit als Regulatoren der Thrombozytenaktivierung und Thrombose eingesetzt.Am wichtigsten ist, dass viele dieser Elemente die Funktion haben, Immunzellen zu verändern.Thrombozyten-ADP wird vom P2Y12ADP-Rezeptor auf dendritischen Zellen (DC) erkannt und erhöht so die Antigen-Endozytose.DC (Antigen-präsentierende Zelle) ist sehr wichtig für die Auslösung der T-Zell-Immunantwort und die Kontrolle der schützenden Immunantwort, die das angeborene Immunsystem und das adaptive Immunsystem verbindet.Darüber hinaus sendet Blutplättchen-Adenosintriphosphat (ATP) Signale über den T-Zell-Rezeptor P2X7, was zu einer verstärkten Differenzierung von CD4-T-Helferzellen in proinflammatorische T-Helfer-17-Zellen (Th17) führt.Andere plättchendichte Granulatkomponenten (wie Glutamat und Serotonin) induzieren die T-Zell-Migration bzw. erhöhen die Differenzierung von Monozyten zu DC.Bei PRP sind diese aus dichten Partikeln gewonnenen Immunmodulatoren stark angereichert und haben wesentliche Immunfunktionen.
Die Zahl der direkten und indirekten möglichen Wechselwirkungen zwischen Blutplättchen und anderen (Rezeptor-)Zellen ist umfangreich.Daher kann die Anwendung von PRP in der lokalen pathologischen Gewebeumgebung eine Vielzahl entzündlicher Wirkungen hervorrufen.
Thrombozytenkonzentration
C-PRP sollte klinische Dosen konzentrierter Blutplättchen enthalten, um positive therapeutische Wirkungen zu erzielen.Blutplättchen in C-PRP sollten die Zellproliferation und die Synthese mesenchymaler und neurotropher Faktoren stimulieren, die Migration chemotaktischer Zellen fördern und die immunregulatorische Aktivität stimulieren, wie in der Abbildung dargestellt.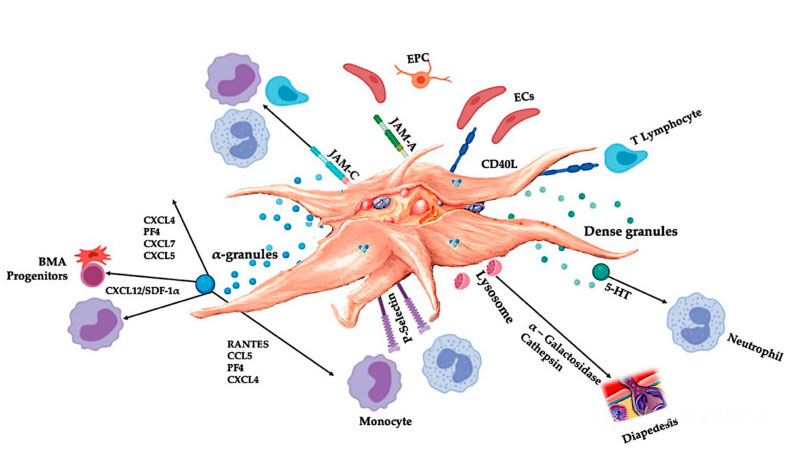
Aktivierte Blutplättchen, die Freisetzung von PGF und Adhäsionsmolekülen vermitteln eine Vielzahl von Zellinteraktionen: Chemotaxis, Zelladhäsion, Migration und Zelldifferenzierung und regulieren immunregulatorische Aktivitäten.Diese Blutplättchen-Zell-Zell-Wechselwirkungen tragen zur Angiogenese und Entzündungsaktivität bei und stimulieren letztendlich den Gewebereparaturprozess.Abkürzungen: BMA: Knochenmarksaspirat, EPC: endotheliale Vorläuferzellen, EC: Endothelzellen, 5-HT: 5-Hydroxytryptamin, RANTES: aktivierte Regulierung der normalen T-Zell-Expression und mutmaßlichen Sekretion, JAM: Junction-Adhäsionsmolekültyp, CD40L: Cluster 40 Ligand, SDF-1 α: Von Stromazellen abgeleiteter Faktor 1 α, CXCL: Chemokin (CXC-Motiv) Ligand, PF4: Thrombozytenfaktor 4. Angepasst von Everts et al.
Marx war der erste, der nachwies, dass die Heilung von Knochen und Weichgewebe verbessert wurde und die minimale Blutplättchenzahl 1 × 10 6 /µL betrug 1,3 × Bei 106 Blutplättchen/µl zeigte diese Studie eine stärkere Fusion.Darüber hinaus haben Giusti et al.Aufgedeckt 1,5 × Der Gewebereparaturmechanismus bei einer Dosis von 109 erfordert Blutplättchen/ml, um funktionelle Angiogenese durch Endothelzellaktivität zu induzieren.In der letztgenannten Studie verringerten höhere Konzentrationen das Angiogenesepotenzial von Blutplättchen in und um Follikel.Darüber hinaus zeigten frühere Daten, dass die PRP-Dosis auch die Behandlungsergebnisse beeinflussen würde.Um die Angiogenese-Reaktion signifikant zu induzieren und die Zellproliferation und Zellmigration zu stimulieren, sollte C-PRP daher mindestens 7,5 in einer 5-ml-PRP-Behandlungsflasche enthalten × 10 9 kann Blutplättchen liefern.
Zusätzlich zur Dosisabhängigkeit scheint die Wirkung von PRP auf die Zellaktivität stark zeitabhängig zu sein.Sophie et al.Diese Ergebnisse legen nahe, dass eine kurzzeitige Exposition gegenüber menschlichen Blutplättchenlysaten die Knochenzellproliferation und Chemotaxis stimulieren kann.Im Gegenteil, eine langfristige PRP-Exposition führt zu geringeren Werten der alkalischen Phosphatase und der Mineralbildung.
rote Blutkörperchen
Rote Blutkörperchen sind für den Sauerstofftransport zum Gewebe und den Transport von Kohlendioxid vom Gewebe zur Lunge verantwortlich.Sie haben keinen Kern und bestehen aus Hämmolekülen, die an Proteine binden.Die Eisen- und Hämbestandteile in den roten Blutkörperchen fördern die Verbindung von Sauerstoff und Kohlendioxid.Im Allgemeinen beträgt der Lebenszyklus roter Blutkörperchen etwa 120 Tage.Sie werden von Makrophagen durch einen Prozess namens Erythrozytenalterung aus dem Blutkreislauf entfernt.Rote Blutkörperchen in PRP-Proben können unter Scherbedingungen geschädigt werden (z. B. Vollblut-Blutungsoperation, immunvermittelter Prozess, oxidativer Stress oder unzureichendes PRP-Konzentrationsschema).Daher zersetzt sich die RBC-Zellmembran und setzt toxisches Hämoglobin (Hb) frei, gemessen durch plasmafreies Hämoglobin (PFH), Häm und Eisen.].PFH und seine Abbauprodukte (Häm und Eisen) führen gemeinsam zu schädlichen und zytotoxischen Wirkungen auf das Gewebe, was zu oxidativem Stress, Stickoxidverlust, Aktivierung von Entzündungswegen und Immunsuppression führt.Diese Effekte führen schließlich zu Störungen der Mikrozirkulation, lokaler Vasokonstriktion und Gefäßverletzungen sowie zu schweren Gewebeschäden.
Das Wichtigste ist, dass bei der Abgabe von Erythrozyten, die C-PRP enthalten, an das Gewebe eine lokale Reaktion namens Eryptose ausgelöst wird, die die Freisetzung eines wirksamen Zytokins und Makrophagen-Migrationshemmers auslöst.Dieses Zytokin hemmt die Migration von Monozyten und Makrophagen.Es übt starke entzündungsfördernde Signale auf das umliegende Gewebe aus, hemmt die Stammzellmigration und die Fibroblastenproliferation und führt zu erheblichen lokalen Zelldysfunktionen.Daher ist es wichtig, die RBC-Kontamination in PRP-Präparaten zu begrenzen.Darüber hinaus wurde die Rolle der roten Blutkörperchen bei der Geweberegeneration nie geklärt.Durch eine angemessene C-PRP-Zentrifugation und einen geeigneten Vorbereitungsprozess wird in der Regel das Vorhandensein roter Blutkörperchen reduziert oder sogar eliminiert, wodurch die nachteiligen Folgen von Hämolyse und Polyzythämie vermieden werden.
Leukozyten in C-PRP
Das Vorhandensein weißer Blutkörperchen in PRP-Präparaten hängt von der Behandlungsausrüstung und dem Zubereitungsschema ab.In plasmabasierten PRP-Geräten werden weiße Blutkörperchen vollständig eliminiert;Allerdings waren die weißen Blutkörperchen in der PRP-Präparation der Erythrozytensedimentationsbraunschicht signifikant konzentriert.Aufgrund ihrer Immun- und Wirtsabwehrmechanismen haben weiße Blutkörperchen großen Einfluss auf die innere Biologie akuter und chronischer Gewebeerkrankungen.Auf diese Funktionen wird weiter unten näher eingegangen.Daher kann das Vorhandensein spezifischer Leukozyten in C-PRP erhebliche Auswirkungen auf Zellen und Gewebe haben.Genauer gesagt verwenden verschiedene PRP-Erythrozytensedimentationssysteme mit braun-gelber Schicht unterschiedliche Vorbereitungsschemata und erzeugen so unterschiedliche Anteile an Neutrophilen, Lymphozyten und Monozyten im PRP.Eosinophile und Basophile können in PRP-Präparaten nicht gemessen werden, da ihre Zellmembranen zu zerbrechlich sind, um den zentrifugalen Verarbeitungskräften standzuhalten.
Neutrophile
Neutrophile sind in vielen Heilungsprozessen essentielle Leukozyten.Diese Wege verbinden sich mit antimikrobiellen Proteinen in Blutplättchen und bilden eine dichte Barriere gegen invasive Krankheitserreger.Das Vorhandensein von Neutrophilen wird anhand des Behandlungsziels von C-PRP bestimmt.Bei der PRP-Biotherapie zur Pflege chronischer Wunden oder bei Anwendungen, die auf Knochenwachstum oder -heilung abzielen, kann ein erhöhtes Maß an Gewebeentzündung erforderlich sein.Wichtig ist, dass in mehreren Modellen zusätzliche Neutrophilenfunktionen gefunden wurden, was ihre Rolle bei der Angiogenese und Gewebereparatur unterstreicht.Allerdings können Neutrophile auch schädliche Wirkungen haben, weshalb sie für einige Anwendungen nicht geeignet sind.Zhou und Wang haben bewiesen, dass die Verwendung von PRP, das reich an Neutrophilen ist, zu einem Anstieg des Verhältnisses von Kollagen Typ III zu Kollagen Typ I führen kann, wodurch die Fibrose verschlimmert und die Sehnenstärke verringert wird.Weitere durch Neutrophile vermittelte schädliche Eigenschaften sind die Freisetzung von entzündlichen Zytokinen und Matrixmetalloproteinasen (MMPs), die bei Anwendung auf Gewebe Entzündungen und Katabolismus fördern können.
Leukomonozyten
Bei C-PRP sind mononukleäre T- und B-Lymphozyten konzentrierter als alle anderen weißen Blutkörperchen.Sie stehen in engem Zusammenhang mit der zellvermittelten zytotoxischen adaptiven Immunität.Lymphozyten können Zellreaktionen auslösen, um Infektionen zu bekämpfen und sich an Eindringlinge anzupassen.Darüber hinaus verstärken von T-Lymphozyten abgeleitete Zytokine (Interferon-γ [IFN-γ] und Interleukin-4 (IL-4) die Polarisation von Makrophagen. Verassar et al. Es ist erwiesen, dass herkömmliche T-Lymphozyten indirekt die Gewebeheilung fördern können im Mausmodell, indem es die Differenzierung von Monozyten und Makrophagen reguliert.
Monozyten – multipotente Reparaturzelle
Abhängig vom verwendeten PRP-Vorbereitungsgerät können Monozyten in der PRP-Behandlungsflasche hervorstehen oder nicht vorhanden sein.Leider werden ihre Leistungsfähigkeit und Regenerationsfähigkeit in der Literatur kaum thematisiert.Daher wird Monozyten bei der Herstellungsmethode oder der Endformel kaum Beachtung geschenkt.Die Monozytengruppe ist heterogen, stammt aus Vorläuferzellen im Knochenmark und wird entsprechend der Mikroumgebungsstimulation über den hämatopoetischen Stammzellweg in periphere Gewebe transportiert.Während der Homöostase und Entzündung verlassen zirkulierende Monozyten den Blutkreislauf und werden in verletztes oder geschädigtes Gewebe rekrutiert.Sie können als Makrophagen (M Φ)-Effektorzellen oder Vorläuferzellen fungieren.Monozyten, Makrophagen und dendritische Zellen stellen das mononukleäre phagozytische System (MPS) dar. Ein typisches Merkmal von MPS ist die Plastizität seines Genexpressionsmusters und die funktionelle Überlappung zwischen diesen Zelltypen.In degenerierten Geweben initiieren residente Makrophagen, lokal wirkende Wachstumsfaktoren, entzündungsfördernde Zytokine, apoptotische oder nekrotische Zellen und mikrobielle Produkte die Differenzierung von Monozyten in MPS-Zellgruppen.Angenommen, wenn C-PRP, das Monozyten mit hoher Ausbeute enthält, in die lokale Mikroumgebung der Krankheit injiziert wird, differenzieren sich Monozyten wahrscheinlich in M Φ, was zu größeren Zellveränderungen führt.
Vom Monozyten zum M Φ Im Prozess der Transformation entsteht ein spezifischer M Φ-Phänotyp.In den letzten zehn Jahren wurde ein Modell entwickelt, das M Φ integriert. Der komplexe Mechanismus der Aktivierung wird als Polarisation zweier entgegengesetzter Zustände beschrieben: M Φ Phänotyp 1 (M Φ 1, klassische Aktivierung) und M Φ Phänotyp 2 (M Φ 2, alternative Aktivierung).M Φ 1 ist durch die Sekretion von entzündlichem Zytokin (IFN-γ) und Stickstoffmonoxid gekennzeichnet, um einen wirksamen Mechanismus zur Abtötung von Krankheitserregern zu erzeugen.M Φ Der Phänotyp produziert auch den vaskulären endothelialen Wachstumsfaktor (VEGF) und den Fibroblasten-Wachstumsfaktor (FGF).M Φ Der Phänotyp besteht aus entzündungshemmenden Zellen mit hoher Phagozytose.M Φ 2 Produziert extrazelluläre Matrixkomponenten, Angiogenese und Chemokine sowie Interleukin 10 (IL-10).Zusätzlich zur Abwehr von Krankheitserregern kann M Φ auch Entzündungen reduzieren und die Gewebereparatur fördern.Bemerkenswert ist, dass M Φ 2 in M in vitro Φ 2a, M Φ 2b und M Φ 2 unterteilt wurde. Dies hängt vom Reiz ab.Die In-vivo-Translation dieser Subtypen ist schwierig, da das Gewebe gemischte M Φ-Gruppen enthalten kann.Interessanterweise kann proinflammatorisches M Φ 1 basierend auf lokalen Umweltsignalen und IL-4-Spiegeln umgewandelt werden, um die Reparatur M Φ 2 zu fördern. Aufgrund dieser Daten ist es vernünftig anzunehmen, dass es hohe Konzentrationen an Monozyten und M Φ C-PRP-Präparaten gibt können zu einer besseren Gewebereparatur beitragen, da sie über entzündungshemmende Fähigkeiten zur Gewebereparatur und Zellsignalübertragung verfügen.
Verwirrte Definition der weißen Blutkörperchenfraktion in PRP
Das Vorhandensein weißer Blutkörperchen in PRP-Behandlungsflaschen hängt vom PRP-Vorbereitungsgerät ab und kann erhebliche Unterschiede aufweisen.Es gibt viele Streitigkeiten über die Existenz von Leukozyten und ihren Beitrag zu verschiedenen Sub-PRP-Produkten (wie PRGF, P-PRP, LP-PRP, LR-PRP, P-PRF und L-PRF). In einer aktuellen Übersicht wurden sechs randomisiert An kontrollierten Studien (Evidenzgrad 1) und drei prospektiven Vergleichsstudien (Evidenzgrad 2) nahmen 1055 Patienten teil, was darauf hinweist, dass LR-PRP und LP-PRP eine ähnliche Sicherheit aufwiesen.Der Autor kam zu dem Schluss, dass die Nebenwirkung von PRP möglicherweise nicht direkt mit der Konzentration weißer Blutkörperchen zusammenhängt.In einer anderen Studie veränderte LR-PRP das entzündliche Interleukin (IL-1) bei OA-Knie (β, IL-6, IL-8 und IL-17) nicht.Diese Ergebnisse stützen die Ansicht, dass die Rolle von Leukozyten bei der biologischen Aktivität von PRP in vivo möglicherweise auf der Wechselwirkung zwischen Blutplättchen und Leukozyten beruht.Diese Wechselwirkung kann die Biosynthese anderer Faktoren (z. B. Lipsauerstoff) fördern, was die Entzündung ausgleichen oder deren Rückbildung fördern kann.Nach der anfänglichen Freisetzung von Entzündungsmolekülen (Arachidonsäure, Leukotrien und Prostaglandin) wird Lipoxygen A4 aus aktivierten Blutplättchen freigesetzt, um die Aktivierung von Neutrophilen zu verhindern.In dieser Umgebung wechselt der M Φ-Phänotyp von M Φ 1 zu M Φ 2. Darüber hinaus gibt es zunehmend Hinweise darauf, dass zirkulierende mononukleäre Zellen aufgrund ihrer Pluripotenz in eine Vielzahl nicht-phagozytischer Zelltypen differenzieren können.
Die Art des PRP beeinflusst die MSC-Kultur.Im Vergleich zu reinen PRP- oder PPP-Proben kann LR-PRP eine deutlich höhere Proliferation von aus dem Knochenmark stammenden MSCs (BMMSCs) mit schnellerer Freisetzung und besserer biologischer PGF-Aktivität induzieren.All diese Eigenschaften tragen dazu bei, Monozyten in die PRP-Behandlungsflasche zu geben und ihre immunmodulatorischen Fähigkeiten und ihr Differenzierungspotenzial zu erkennen.
Angeborene und adaptive Immunregulation von PRP
Die bekannteste physiologische Funktion von Blutplättchen ist die Kontrolle von Blutungen.Sie sammeln sich an der Stelle der Gewebeschädigung und den beschädigten Blutgefäßen an.Diese Ereignisse werden durch die Expression von Integrinen und Selektinen verursacht, die die Adhäsion und Aggregation von Blutplättchen stimulieren.Das geschädigte Endothel verschlimmert diesen Prozess zusätzlich und das freigelegte Kollagen und andere subendotheliale Matrixproteine fördern die Tiefenaktivierung der Blutplättchen.In diesen Fällen wurde die wichtige Rolle der Wechselwirkung zwischen von Willebrand-Faktor (vWF) und Glykoprotein (GP), insbesondere GP-Ib, nachgewiesen.Nach der Thrombozytenaktivierung regulieren Thrombozyten-α-, -Lysosom- und -T-Granula die Exozytose und geben ihren Inhalt in die extrazelluläre Umgebung ab.
Thrombozytenadhäsionsmolekül
Um die Rolle von PRP in entzündlichen Geweben und Blutplättchen bei der Immunantwort besser zu verstehen, sollten wir verstehen, wie verschiedene Thrombozytenoberflächenrezeptoren (Integrine) und Verbindungsadhäsionsmoleküle (JAM) sowie Zellinteraktionen kritische Prozesse der angeborenen und adaptiven Immunität auslösen können.
Integrine sind Zelloberflächenadhäsionsmoleküle, die in verschiedenen Zelltypen vorkommen und in großen Mengen auf Blutplättchen exprimiert werden.Zu den Integrinen gehören a5b1, a6b1, a2b1 LFA-2 (GPIa/IIa) und aIIbb3 (GPIIb/IIIa).Normalerweise liegen sie in einem statischen Zustand mit geringer Affinität vor.Nach der Aktivierung wechseln sie in den Zustand hoher Ligandenbindungsaffinität.Integrine haben unterschiedliche Funktionen auf Blutplättchen und sind an der Interaktion von Blutplättchen mit verschiedenen Arten weißer Blutkörperchen, Endothelzellen und extrazellulärer Matrix beteiligt.Darüber hinaus wird der GP-Ib-V-IX-Komplex auf der Blutplättchenmembran exprimiert und ist der Hauptrezeptor für die Bindung mit von vWF.Diese Interaktion vermittelt den ersten Kontakt zwischen Blutplättchen und freiliegenden subendothelialen Strukturen.Thrombozytenintegrin und GP-Komplex stehen im Zusammenhang mit verschiedenen Entzündungsprozessen und spielen eine wichtige Rolle bei der Bildung des Thrombozyten-Leukozyten-Komplexes.Insbesondere ist Integrin aIIbb3 notwendig, um durch die Kombination von Fibrinogen mit dem Makrophagen-1-Antigen (Mac-1)-Rezeptor auf Neutrophilen einen stabilen Komplex zu bilden.
Blutplättchen, Neutrophile und Gefäßendothelzellen exprimieren spezifische Zelladhäsionsmoleküle, sogenannte Selectin.Unter entzündlichen Bedingungen exprimieren Blutplättchen P-Selectin und neutrophiles L-Selectin.Nach der Thrombozytenaktivierung kann P-Selectin an den Liganden PSGL-1 binden, der auf Neutrophilen und Monozyten vorhanden ist.Darüber hinaus löst die PSGL-1-Bindung eine intrazelluläre Signalkaskadenreaktion aus, die Neutrophile über das Neutrophilen-Integrin Mac-1 und das Lymphozytenfunktionsbezogene Antigen 1 (LFA-1) aktiviert.Aktiviertes Mac-1 bindet über Fibrinogen an GPIb oder GPIIb/IIIa auf Blutplättchen und stabilisiert so die Interaktion zwischen Neutrophilen und Blutplättchen.Darüber hinaus kann sich aktiviertes LFA-1 mit dem interzellulären Adhäsionsmolekül 2 der Blutplättchen verbinden, um den Neutrophilen-Blutplättchen-Komplex weiter zu stabilisieren und so die langfristige Adhäsion an Zellen zu fördern.
Blutplättchen und Leukozyten spielen eine Schlüsselrolle bei der angeborenen und adaptiven Immunantwort
Der Körper kann Fremdkörper und verletztes Gewebe bei akuten oder chronischen Erkrankungen erkennen, um eine Wundheilungskaskade und einen Entzündungsweg einzuleiten.Das angeborene und das adaptive Immunsystem schützen den Wirt vor Infektionen, und weiße Blutkörperchen spielen eine wichtige Rolle bei der Überlappung der beiden Systeme.Insbesondere Monozyten, Makrophagen, Neutrophile und natürliche Killerzellen spielen eine Schlüsselrolle im angeborenen System, während Lymphozyten und ihre Untergruppen eine ähnliche Rolle im adaptiven Immunsystem spielen.
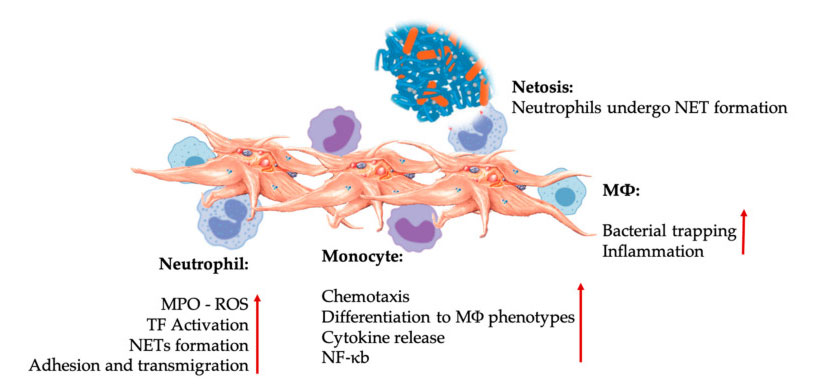
Interaktionen zwischen Blutplättchen und Leukozyten bei Interaktionen mit Zellen des angeborenen Immunsystems.Blutplättchen interagieren mit Neutrophilen und Monozyten und schließlich mit M Φ. Sie interagieren, passen ihre Effektorfunktionen an und erhöhen sie.Diese Blutplättchen-Leukozyten-Wechselwirkungen führen über verschiedene Mechanismen, einschließlich NETose, zu Entzündungen.Abkürzungen: MPO: Myeloperoxidase, ROS: reaktive Sauerstoffspezies, TF: Gewebefaktor, NET: extrazelluläre Falle für Neutrophile, NF- κ B: Kernfaktor Kappa B, M Φ: Makrophagen.
Angeborenes Immunsystem
Die Aufgabe des angeborenen Immunsystems besteht darin, invasive Mikroorganismen oder Gewebefragmente unspezifisch zu identifizieren und deren Beseitigung zu stimulieren.Wenn sich bestimmte molekulare Strukturen, sogenannte Surface Expression Pattern Recognition Receptors (PRRs), mit pathogenbezogenen molekularen Mustern und schädigungsbezogenen molekularen Mustern verbinden, wird das angeborene Immunsystem aktiviert.Es gibt viele Arten von PRRs, einschließlich des Toll-like-Rezeptors (TLR) und des RIG-1-ähnlichen Rezeptors (RLR).Diese Rezeptoren können den Haupttranskriptionsfaktor Kappa B (NF-κ B) aktivieren. Er reguliert auch mehrere Aspekte der angeborenen und adaptiven Immunantwort.Interessanterweise exprimieren Blutplättchen auch eine Vielzahl immunregulatorischer Rezeptormoleküle auf ihrer Oberfläche und im Zytoplasma, wie z. B. P-Selectin, den Transmembranprotein-CD40-Liganden (CD40L), Zytokine (wie IL-1 β、 TGF- β) und plättchenspezifisches TLR. Daher können Blutplättchen mit verschiedenen Immunzellen interagieren.
Interaktion zwischen Blutplättchen und weißen Blutkörperchen bei der angeborenen Immunität
Wenn Blutplättchen in den Blutfluss oder in das Gewebe gelangen oder eindringen, sind Blutplättchen eine der Zellen, die Endothelschäden und mikrobielle Krankheitserreger zuerst erkennen.Thrombozytenaggregation und fördern die Freisetzung der Thrombozytenagonisten ADP, Thrombin und vWF, was zur Thrombozytenaktivierung und der Expression der Thrombozyten-Chemokinrezeptoren C, CC, CXC und CX3C führt und so Blutplättchen an der infizierten Stelle oder Verletzungen verursacht.
Das angeborene Immunsystem ist genetisch darauf ausgelegt, Eindringlinge wie Viren, Bakterien, Parasiten und Toxine oder Gewebewunden und Wunden zu erkennen.Es handelt sich um ein unspezifisches System, da jeder Krankheitserreger als fremd oder körperfremd identifiziert und schnell lokalisiert werden kann.Das angeborene Immunsystem basiert auf einer Reihe von Proteinen und Phagozyten, die die gut erhaltenen Eigenschaften von Krankheitserregern erkennen und schnell die Immunantwort aktivieren, um Eindringlinge zu eliminieren, selbst wenn der Wirt noch nie zuvor bestimmten Krankheitserregern ausgesetzt war.
Neutrophile, Monozyten und dendritische Zellen sind die häufigsten angeborenen Immunzellen im Blut.Ihre Rekrutierung ist für eine adäquate frühe Immunantwort notwendig.Wenn PRP in der regenerativen Medizin eingesetzt wird, reguliert die Interaktion zwischen Blutplättchen und weißen Blutkörperchen Entzündungen, Wundheilung und Gewebereparatur.TLR-4 auf Blutplättchen stimuliert die Wechselwirkung zwischen Blutplättchen und Neutrophilen, die den sogenannten Leukozyten-Oxidationsstoß reguliert, indem sie die Freisetzung reaktiver Sauerstoffspezies (ROS) und Myeloperoxidase (MPO) aus Neutrophilen reguliert.Darüber hinaus führt die Wechselwirkung zwischen Thrombozyten-Neutrophilen und Neutrophilen-Degranulation zur Bildung von Neutrophilen-extrazellulären Fallen (NETs).NETs bestehen aus dem Kern von Neutrophilen und anderen intrazellulären Inhalten von Neutrophilen, die Bakterien einfangen und durch NETose abtöten können.Die Bildung von NETs ist ein wesentlicher Abtötungsmechanismus von Neutrophilen.
Nach der Thrombozytenaktivierung können Monozyten in erkrankte und degenerative Gewebe wandern, wo sie Adhäsionsaktivitäten ausführen und entzündliche Moleküle absondern, die die Chemotaxis und proteolytischen Eigenschaften verändern können.Darüber hinaus können Blutplättchen die NF-κB-Aktivierung von Monozyten induzieren, um die Effektorfunktion von Monozyten zu regulieren, die der Schlüsselmediator der Entzündungsreaktion sowie der Aktivierung und Differenzierung von Immunzellen ist.Blutplättchen fördern zusätzlich den endogenen oxidativen Ausbruch von Monozyten, um die Zerstörung phagozytischer Krankheitserreger zu fördern.Die Freisetzung von MPO wird durch die direkte Interaktion zwischen Thrombozyten-Monozyten CD40L-MAC-1 vermittelt.Interessanterweise können die von Blutplättchen abgeleiteten Chemokine PF4, RANTES, IL-1 β und CXCL-12, wenn P-Selectin Blutplättchen unter akuten und chronischen entzündlichen Gewebezuständen aktiviert, die spontane Apoptose von Monozyten verhindern, aber ihre Differenzierung in Makrophagen fördern.
Adaptives Immunsystem
Nachdem das unspezifische angeborene Immunsystem den mikrobiellen oder Gewebeschaden erkennt, übernimmt das spezifische adaptive Immunsystem.Zu den adaptiven Systemen gehören Antigen-bindende B-Lymphozyten (B-Zellen) und konventionelle T-Lymphozyten (Treg), die die Beseitigung von Krankheitserregern koordinieren.T-Zellen können grob in Helfer-T-Zellen (Th-Zellen) und zytotoxische T-Zellen (Tc-Zellen, auch T-Killerzellen genannt) unterteilt werden.Th-Zellen werden weiter in Th1-, Th2- und Th17-Zellen unterteilt, die Schlüsselfunktionen bei Entzündungen haben.Th-Zellen können proinflammatorische Zytokine (z. B. IFN-γ, TNF-β) und mehrere Interleukine (z. B. IL-17) absondern. Sie sind besonders wirksam bei der Vorbeugung intrazellulärer Virus- und Bakterieninfektionen. Th-Zellen stimulieren die Proliferation und Differenzierung der daran beteiligten Zellen Immunantwort. Tc-Zellen sind Effektorzellen, die gezielt intrazelluläre und extrazelluläre Mikroorganismen und Zellen eliminieren können.
Interessanterweise produzieren Th2-Zellen IL-4 und beeinflussen die M Φ-Polarisation, die M Φ-gesteuerte Regeneration des M Φ 2-Phänotyps, während IFN- γ M Φ zum entzündlichen M Φ 1-Phänotyp wechselt, der von der Dosis und der Zeit der Zytokine abhängt.Nachdem IL-4 aktiviert wurde, induziert M Φ 2 die Differenzierung von Treg-Zellen in Th2-Zellen und produziert dann zusätzliches IL-4 (positive Rückkopplungsschleife).Th-Zellen wandeln den M Φ-Phänotyp als Reaktion auf biologische Wirkstoffe aus Gewebe in den regenerativen Phänotyp um.Dieser Mechanismus basiert auf dem Beweis, dass Th-Zellen eine wichtige Rolle bei der Kontrolle von Entzündungen und der Gewebereparatur spielen.
Interaktion zwischen Blutplättchen und weißen Blutkörperchen bei der adaptiven Immunität
Das adaptive Immunsystem verwendet antigenspezifische Rezeptoren, erinnert sich an zuvor aufgetretene Krankheitserreger und zerstört sie, wenn es anschließend auf den Wirt trifft.Diese adaptiven Immunantworten entwickelten sich jedoch langsam.Konias et al.Es zeigt, dass die Thrombozytenkomponente zur Risikowahrnehmung und Gewebereparatur beiträgt und dass die Interaktion zwischen Thrombozyten und Leukozyten die Aktivierung der adaptiven Immunantwort fördert.
Während der adaptiven Immunantwort fördern Blutplättchen Monozyten- und Makrophagenreaktionen durch die Reifung von DC- und NK-Zellen, was zu spezifischen T-Zell- und B-Zell-Reaktionen führt.Daher wirken sich die Bestandteile der Blutplättchenkörner direkt auf die adaptive Immunität aus, indem sie CD40L exprimieren, ein Molekül, das für die Regulierung der adaptiven Immunantwort unerlässlich ist.Blutplättchen spielen über CD40L nicht nur eine Rolle bei der Antigenpräsentation, sondern beeinflussen auch die T-Zell-Reaktion.Liu et al.Es wurde festgestellt, dass Blutplättchen die CD4-T-Zellantwort auf komplexe Weise regulieren.Diese unterschiedliche Regulierung von CD4-T-Zell-Untergruppen bedeutet, dass Blutplättchen die Reaktion von CD4-T-Zellen auf Entzündungsreize fördern und so starke entzündungsfördernde und entzündungshemmende Reaktionen hervorrufen.
Blutplättchen regulieren auch die durch B-Zellen vermittelte adaptive Reaktion auf mikrobielle Krankheitserreger.Es ist bekannt, dass CD40L auf aktivierten CD4-T-Zellen CD40 von B-Zellen auslöst und das zweite Signal liefert, das für die T-Zell-abhängige Aktivierung von B-Lymphozyten, die anschließende Allotypumwandlung sowie die Differenzierung und Proliferation von B-Zellen erforderlich ist.Im Allgemeinen zeigen die Ergebnisse deutlich die verschiedenen Funktionen von Blutplättchen bei der adaptiven Immunität, was darauf hindeutet, dass Blutplättchen die Interaktion zwischen T-Zellen und B-Zellen über CD40-CD40L verbinden und so die T-Zell-abhängige B-Zell-Reaktion verstärken.Darüber hinaus sind Blutplättchen reich an Zelloberflächenrezeptoren, die die Blutplättchenaktivierung fördern und eine große Anzahl entzündlicher und biologisch aktiver Moleküle freisetzen können, die in verschiedenen Blutplättchenpartikeln gespeichert sind, und so die angeborene und adaptive Immunantwort beeinflussen.
Erweiterte Rolle von aus Blutplättchen gewonnenem Serotonin bei PRP
Serotonin (5-Hydroxytryptamin, 5-HT) spielt eindeutig eine Schlüsselrolle im Zentralnervensystem (ZNS), einschließlich der Schmerztoleranz.Es wird geschätzt, dass der größte Teil des menschlichen 5-HT im Magen-Darm-Trakt und dann über den Blutkreislauf produziert wird, wo es über den Serotonin-Wiederaufnahmetransporter von Blutplättchen absorbiert und in dichten Partikeln in hoher Konzentration (65 mmol/l) gespeichert wird.5-HT ist ein bekannter Neurotransmitter und Hormon, das bei der Regulierung verschiedener neuropsychologischer Prozesse im ZNS (zentrales 5-HT) hilft.Der größte Teil von 5-HT existiert jedoch außerhalb des ZNS (peripheres 5-HT) und ist an der Regulierung der systemischen und zellulären biologischen Funktionen mehrerer Organsysteme beteiligt, darunter Herz-Kreislauf-, Lungen-, Magen-Darm-, Urogenital- und Blutplättchenfunktionssysteme.5-HT hat einen konzentrationsabhängigen Stoffwechsel auf einer Vielzahl von Zelltypen, einschließlich Adipozyten, Epithelzellen und weißen Blutkörperchen.Peripheres 5-HT ist außerdem ein starker Immunmodulator, der über seinen spezifischen 5-HT-Rezeptor (5HTR) Entzündungen stimulieren oder hemmen und verschiedene Immunzellen beeinflussen kann.
Parakriner und autokriner Mechanismus der HT
Die Aktivität von 5-HT wird durch seine Wechselwirkung mit 5HTRs vermittelt, einer Superfamilie mit sieben Mitgliedern (5-HT 1 – 7) und mindestens 14 verschiedenen Rezeptorsubtypen, einschließlich des kürzlich entdeckten Mitglieds 5-HT 7, seiner peripheren und Funktion in der Schmerztherapie.Bei der Degranulation der Blutplättchen sezernieren aktivierte Blutplättchen eine große Menge von Blutplättchen-abgeleitetem 5-HT, das die Gefäßkontraktion fördern und die Aktivierung benachbarter Blutplättchen und Lymphozyten durch die Expression von 5-HTR auf Endothelzellen, glatten Muskelzellen usw. stimulieren kann Immunzellen.Pacala et al.Die mitotische Wirkung von 5-HT auf Gefäßendothelzellen wurde untersucht und das Potenzial zur Förderung des Wachstums beschädigter Blutgefäße durch Stimulierung der Angiogenese bestimmt.Wie diese Prozesse reguliert werden, ist nicht völlig klar, aber es könnte sich dabei um unterschiedliche wechselseitige Signalwege im Mikrokreislauf des Gewebes handeln, um die Funktionen von Gefäßendothelzellen und glatten Muskelzellen, Fibroblasten und Immunzellen über spezifische 5-HT-Rezeptoren auf diesen Zellen zu regulieren .Die autokrine Funktion von Thrombozyten-5-HT nach Thrombozytenaktivierung wurde beschrieben [REF].Die Freisetzung von 5-HT steigert die Aktivierung von Blutplättchen und die Rekrutierung zirkulierender Blutplättchen, was zur Aktivierung von Signalkaskadenreaktionen und vorgeschalteten Effektoren führt, die die Blutplättchenreaktivität unterstützen.
Immunmodulatorische 5-HT-Wirkung
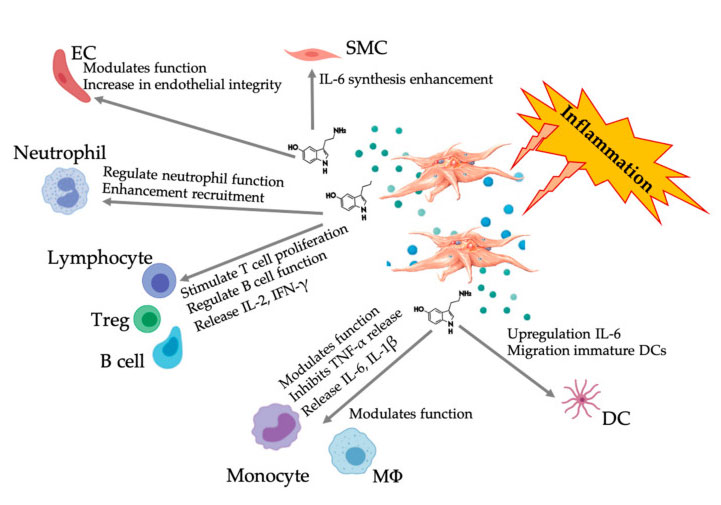
Immer mehr Beweise zeigen, dass Serotonin als Immunmodulator eine Rolle bei verschiedenen 5HTR spielen kann.Laut 5HTR, das in verschiedenen Leukozyten exprimiert wird, die an Entzündungsreaktionen beteiligt sind, fungiert aus Blutplättchen gewonnenes 5-HT als Immunregulator sowohl im angeborenen als auch im adaptiven Immunsystem.5-HT kann die Treg-Proliferation stimulieren und die Funktionen von B-Zellen, natürlichen Killerzellen und Neutrophilen regulieren, indem es DC und Monozyten an die Entzündungsstelle rekrutiert.Aktuelle Studien haben gezeigt, dass aus Blutplättchen gewonnenes 5-HT die Funktion von Immunzellen unter bestimmten Bedingungen regulieren kann.Daher kann bei Verwendung von C-PRP eine Thrombozytenkonzentration von mehr als 1 × 10 6/µL erheblich dazu beitragen, die Konzentration von 5-HT aus großen Thrombozyten in das Gewebe zu transportieren.In der Mikroumgebung, die durch entzündliche Komponenten gekennzeichnet ist, kann PRP mit mehreren Immunzellen interagieren, die bei diesen Pathologien eine Schlüsselrolle spielen, was sich auf die klinischen Ergebnisse auswirken kann.
Die Abbildung zeigt die vielfältige 5-HT-Reaktion nach der Aktivierung entzündlicher PRP-Blutplättchen.Nach der Aktivierung der Blutplättchen setzen die Blutplättchen ihre Körnchen frei, darunter 5-HT in dichten Körnchen, was vielfältige unterschiedliche Wirkungen auf verschiedene Immunzellen, Endothelzellen und glatte Muskelzellen hat.Abkürzungen: SMC: glatte Muskelzellen, EC: Endothelzellen, Treg: konventionelle T-Lymphozyten, M Φ: Makrophagen, DC: dendritische Zellen, IL: Interleukin, IFN- γ: Interferon γ. Modifiziert und angepasst von Everts et al.und Hull et al.
Analgetische Wirkung von PRP
Aktivierte Blutplättchen setzen viele entzündungsfördernde und entzündungshemmende Mediatoren frei, die nicht nur Schmerzen verursachen, sondern auch Entzündungen und Schmerzen lindern können.Nach der Anwendung verändert die typische Thrombozytendynamik von PRP die Mikroumgebung vor der Gewebereparatur und -regeneration über eine Vielzahl komplexer Wege im Zusammenhang mit Anabolismus und Katabolismus, Zellproliferation, Differenzierung und Stammzellregulation.Diese Eigenschaften von PRP führen zur Anwendung von PRP bei verschiedenen klinisch-pathologischen Zuständen, die üblicherweise mit chronischen Schmerzen einhergehen (z. B. Sportverletzungen, orthopädische Erkrankungen, Erkrankungen der Wirbelsäule und komplexe chronische Wunden), obwohl der genaue Mechanismus noch nicht vollständig geklärt ist.
Im Jahr 2008 haben Evertz et al.Es ist die erste randomisierte kontrollierte Studie, die über die analgetische Wirkung eines PRP-Präparats berichtet, das aus der braunen Schicht der autologen Erythrozytensedimentationsrate hergestellt und nach einer Schulteroperation mit autologem Thrombin aktiviert wird.Sie stellten einen signifikanten Rückgang der Ergebnisse auf der visuellen Analogskala, den Einsatz opioidbasierter Analgetika und eine erfolgreichere postoperative Rehabilitation fest.Bemerkenswert ist, dass sie die analgetische Wirkung aktivierter Blutplättchen widerspiegeln und über den Mechanismus der Blutplättchenfreisetzung von 5-HT spekulieren.Kurz gesagt, Blutplättchen ruhen in frisch zubereitetem PRP.Nach der direkten oder indirekten Aktivierung der Blutplättchen (Gewebefaktor) ändern die Blutplättchen ihre Form und produzieren so eine falsche Form, dass die Blutplättchenaggregation gefördert wird.Dann setzen sie intrazelluläre α- und dichte Partikel frei.Das mit aktiviertem PRP behandelte Gewebe wird von PGF, Zytokinen und anderen Blutplättchen-Lysosomen befallen.Genauer gesagt, wenn dichte Partikel ihren Inhalt freisetzen, setzen sie eine große Menge 5-HT frei, das Schmerzen reguliert.Bei C-PRP ist die Thrombozytenkonzentration fünf- bis siebenmal höher als im peripheren Blut.Daher ist die Freisetzung von 5-HT aus Blutplättchen astronomisch.Interessanterweise haben Sprott et al.In dem Bericht wurde festgestellt, dass die Schmerzen nach Akupunktur und Moxibustion deutlich gelindert wurden, die Konzentration von aus Blutplättchen stammendem 5-HT deutlich reduziert wurde und anschließend der Plasmaspiegel von 5-HT anstieg.
In der Peripherie setzen Blutplättchen, Mastzellen und Endothelzellen bei Gewebeverletzungen oder chirurgischen Traumata endogenes 5-HT frei.Interessanterweise wurden im peripheren Bereich verschiedene 5-HT-Rezeptoren von Neuronen nachgewiesen, was bestätigte, dass 5-HT die nozizeptive Übertragung im peripheren Bereich stören kann.Diese Studien zeigen, dass 5-HT die nozizeptive Übertragung peripherer Gewebe über 5-HT1-, 5-HT2-, 5-HT3-, 5-HT4- und 5-HT7-Rezeptoren beeinflussen kann.
Das 5-HT-System stellt ein leistungsstarkes System dar, das den Schmerz nach schädlicher Stimulation reduzieren und verstärken kann.Bei Patienten mit chronischen Schmerzen wurde über die zentrale und periphere Regulierung nozizeptiver Signale und Veränderungen im 5-HT-System berichtet.In den letzten Jahren konzentrierten sich zahlreiche Studien auf die Rolle von 5-HT und seinen jeweiligen Rezeptoren bei der Verarbeitung und Regulierung schädlicher Informationen, was zu Medikamenten wie selektiven Serotonin-Wiederaufnahmehemmern (SSRI) führte.Dieses Medikament hemmt die Wiederaufnahme von Serotonin in präsynaptische Neuronen nach der Freisetzung von Serotonin.Es beeinflusst die Dauer und Intensität der Serotoninkommunikation und ist eine alternative Behandlung chronischer Schmerzen.Weitere klinische Forschung ist erforderlich, um den molekularen Mechanismus der PRP-abgeleiteten 5-HT-Schmerzregulation bei chronischen und degenerativen Erkrankungen klar zu verstehen.
Weitere Daten zur Aufklärung der möglichen analgetischen Wirkung von PRP können nach dem analgetischen Tiermodelltest gewonnen werden.Die vergleichenden statistischen Schlussfolgerungen in diesen Modellen sind eine Herausforderung, da diese Studien zu viele Variablen enthalten.Dennoch haben sich einige klinische Studien mit den nozizeptiven und analgetischen Wirkungen von PRP befasst.Mehrere Studien haben gezeigt, dass Patienten, die wegen Tendinose oder Rotatorenmanschettenriss behandelt werden, kaum eine Schmerzlinderung verspüren.Im Gegensatz dazu haben mehrere andere Studien gezeigt, dass PRP die Schmerzen von Patienten mit Sehnendegeneration, Arthrose, Plantarfasziitis und anderen Fuß- und Knöchelerkrankungen lindern oder sogar beseitigen kann.Die endgültige Blutplättchenkonzentration und die biologische Zellzusammensetzung wurden als die wichtigsten PRP-Merkmale identifiziert, die helfen, die konsistente analgetische Wirkung nach der Anwendung von PRP zu beobachten.Weitere Variablen sind die PRP-Abgabemethode, die Anwendungstechnologie, das Blutplättchenaktivierungsprotokoll, der Grad der biologischen Aktivität von PGF und freigesetzten Zytokinen, der Gewebetyp der PRP-Anwendung und die Art der Verletzung.
Es ist bemerkenswert, dass Kuffler das Potenzial von PRP zur Schmerzlinderung bei Patienten mit leichten bis schweren chronischen neuropathischen Schmerzen erkannte, die auf den geschädigten nicht regenerativen Nerv zurückzuführen sind.Der Zweck dieser Studie besteht darin, zu untersuchen, ob neuropathische Schmerzen aufgrund von PRP, das die axonale Regeneration und die Reinnervation des Zielnervs fördert, reduziert oder nachgelassen werden können.Überraschenderweise sind die neuropathischen Schmerzen bei den behandelten Patienten auch mindestens sechs Jahre nach der Operation immer noch beseitigt oder gelindert.Darüber hinaus begann bei allen Patienten innerhalb von drei Wochen nach der Anwendung von PRP eine Schmerzlinderung.
Ähnliche analgetische PRP-Wirkungen wurden kürzlich auch im Bereich der postoperativen Wund- und Hautpflege beobachtet.Interessanterweise berichteten die Autoren über die physiologischen Aspekte von Wundschmerzen im Zusammenhang mit Gefäßverletzungen und Hautgewebehypoxie.Sie diskutierten auch die Bedeutung der Angiogenese für die Optimierung der Sauerstoffversorgung und Nährstoffversorgung.Ihre Studie zeigte, dass Patienten, die eine PRP-Behandlung erhielten, im Vergleich zur Kontrollgruppe weniger Schmerzen hatten und die Angiogenese deutlich steigerten.Schließlich führten Johal und seine Kollegen eine systematische Überprüfung und Metaanalyse durch und kamen zu dem Schluss, dass PRP die Schmerzen nach der Anwendung von PRP bei orthopädischen Indikationen lindern kann, insbesondere bei Patienten, die eine externe Epicondylitis- und Knie-OA-Behandlung erhalten.Leider wurden in dieser Studie die Auswirkungen der weißen Blutkörperchen, der Blutplättchenkonzentration oder der Verwendung exogener Blutplättchenaktivatoren nicht spezifiziert, da diese Variablen die Gesamtwirksamkeit von PRP beeinflussen würden.Die optimale PRP-Thrombozytenkonzentration für eine maximale Schmerzlinderung ist unklar.Im Rattenmodell der Tendinose betrug die Thrombozytenkonzentration 1,0 × 10 6 / μ. Bei L kann der Schmerz vollständig gelindert werden, während die durch PRP verursachte Schmerzlinderung bei halber Thrombozytenkonzentration deutlich reduziert wird.Daher ermutigen wir weitere klinische Studien, um die analgetische Wirkung verschiedener PRP-Präparate zu untersuchen.
PRP- und Angiogenese-Effekt
C-PRP-Präparate in der präzisen regenerativen Medizin ermöglichen die Abgabe von Biomolekülen, die durch hohe Konzentrationen von Blutplättchen freigesetzt werden, die an Zielgewebestellen aktiviert werden.Daher wurden verschiedene Kaskadenreaktionen initiiert, die zur lokalen Immunregulation, zum Entzündungsprozess und zur Angiogenese beitragen und so die Heilung und Gewebereparatur fördern.
Angiogenese ist ein dynamischer, mehrstufiger Prozess, bei dem Mikrogefäße aus bereits vorhandenen Blutgefäßen keimen und Gewebe bilden.Die Angiogenese hat aufgrund einer Vielzahl biologischer Mechanismen Fortschritte gemacht, darunter die Migration, Proliferation, Differenzierung und Teilung von Endothelzellen.Diese zellulären Prozesse sind Voraussetzungen für die Bildung neuer Blutgefäße.Sie sind wichtig für das Wachstum bereits bestehender Blutgefäße, um den Blutfluss wiederherzustellen und die hohe Stoffwechselaktivität der Gewebereparatur und Geweberegeneration zu unterstützen.Diese neuen Blutgefäße ermöglichen die Zufuhr von Sauerstoff und Nährstoffen sowie die Entfernung von Nebenprodukten aus behandeltem Gewebe.
Die Angiogeneseaktivität wird durch den stimulierenden angiogenetischen Faktor VEGF und antiangiogene Faktoren (z. B. Angiostatin und Thrombospondin-1 [TSP-1]) reguliert.In der erkrankten und geschädigten Mikroumgebung (einschließlich niedriger Sauerstoffspannung, niedrigem pH-Wert und hohem Milchsäurespiegel) stellen lokale angiogene Faktoren die Angiogeneseaktivität wieder her.
Mehrere plättchenlösliche Medien wie basisches FGF und TGF-β und VEGF können Endothelzellen zur Bildung neuer Blutgefäße anregen.Landsdown und Fortier berichteten über verschiedene Ergebnisse im Zusammenhang mit der PRP-Zusammensetzung, einschließlich der intraplättchenförmigen Quellen vieler angiogener Regulatoren.Darüber hinaus kamen sie zu dem Schluss, dass die Steigerung der Angiogenese zur Heilung der MSK-Erkrankung in Bereichen mit schlechter Vaskularisierung beiträgt, wie zum Beispiel bei Meniskusrissen, Sehnenverletzungen und anderen Bereichen mit schlechter Vaskularisierung.
Fördernde und antiangiogenetische Eigenschaften der Blutplättchen
In den letzten Jahrzehnten haben veröffentlichte Studien gezeigt, dass Blutplättchen eine Schlüsselrolle bei der primären Blutstillung, der Gerinnselbildung, der Freisetzung von Wachstumsfaktoren und Zytokinen sowie der Angiogeneseregulierung als Teil des Gewebereparaturprozesses spielen.Paradoxerweise enthält das PRP α-Granulat ein Arsenal an proangiogenetischen Wachstumsfaktoren, antiangiogenetischen Proteinen und Zytokinen (wie PF4, Plasminogenaktivator-Inhibitor-1 und TSP-1) und zielt auf die Freisetzung spezifischer Faktoren ab, die eine Rolle spielen .Rolle bei der Angiogenese.Daher kann die Rolle von PRP bei der Steuerung der Angiogenese-Regulierung durch die Aktivierung spezifischer Zelloberflächenrezeptoren, TGF-β, definiert werden, die proangiogene und antiangiogene Reaktionen auslösen.Die Fähigkeit von Blutplättchen, den Angiogeneseweg auszuüben, wurde bei der pathologischen Angiogenese und der Tumorangiogenese bestätigt.
Von Blutplättchen abgeleiteter angiogener Wachstumsfaktor und antiangiogener Wachstumsfaktor, abgeleitet von α- und dichten und adhäsiven Molekülen.Am wichtigsten ist, dass allgemein anerkannt ist, dass die Gesamtwirkung von Blutplättchen auf die Angiogenese proangiogen und stimulierend ist.Es wird erwartet, dass die PRP-Therapie die Induktion der Angiogenese kontrolliert, was zur Behandlungswirkung vieler Krankheiten wie Wundheilung und Gewebereparatur beitragen wird.Die Verabreichung von PRP, insbesondere die Verabreichung von hochkonzentriertem PGF und anderen Thrombozytenzytokinen, kann Angiogenese, Angiogenese und Arteriogenese induzieren, da der aus Stromazellen stammende Faktor 1a an den CXCR4-Rezeptor auf endothelialen Vorläuferzellen bindet.Bill et al.Es wird vermutet, dass PRP die ischämische Neovaskularisation erhöht, was möglicherweise auf die Stimulation der Angiogenese, Angiogenese und Arteriogenese zurückzuführen ist.In ihrem In-vitro-Modell wurden die Endothelzellproliferation und die Kapillarbildung durch eine große Anzahl verschiedener PDGs induziert, von denen VEGF der wichtigste angiogene Stimulator war.Ein weiterer wichtiger und wesentlicher Faktor für die Wiederherstellung des Angiogenesewegs ist die Synergie zwischen mehreren PGFs.Richardson et al.Es wurde nachgewiesen, dass die synergistische Aktivität des angiogenen Faktors Platelet-Derived Growth Factor-BB (PDGF-BB) und VEGF im Vergleich zur Aktivität des einzelnen Wachstumsfaktors zur schnellen Bildung eines reifen Gefäßnetzwerks führte.Die kombinierte Wirkung dieser Faktoren wurde kürzlich in einer Studie zur Verbesserung der zerebralen Kollateralzirkulation bei Mäusen mit langfristiger Minderdurchblutung bestätigt.
Am wichtigsten ist, dass in einer In-vitro-Studie die proliferative Wirkung menschlicher Endothelzellen aus der Nabelschnurvene und verschiedener Blutplättchenkonzentrationen auf die Auswahl des PRP-Vorbereitungsgeräts und die Strategie zur Blutplättchendosis gemessen wurden. Die Ergebnisse zeigten, dass die optimale Blutplättchendosis 1,5 × 10 6 Blutplättchen/μ betrug 50. Zur Förderung der Angiogenese.Eine zu hohe Thrombozytenkonzentration kann den Angiogeneseprozess hemmen, sodass die Wirkung gering ist.
Zellalterung, Alterung und PRP
Zellalterung kann durch verschiedene Reize induziert werden.Hierbei handelt es sich um einen Prozess, bei dem Zellen aufhören, sich zu teilen und einzigartige phänotypische Veränderungen durchlaufen, um das uneingeschränkte Wachstum beschädigter Zellen zu verhindern, was eine wichtige Rolle bei der Krebsprävention spielt.Im Prozess der physiologischen Alterung fördert die Zellreplikationsalterung auch die Zellalterung und die Regenerationsfähigkeit von MSCs wird verringert.
Auswirkungen des Alterns und der Zellalterung
In vivo altern viele Zelltypen und sammeln sich während des Alterns in verschiedenen Geweben an, darunter eine große Anzahl alternder Zellen.Die Ansammlung alternder Zellen scheint mit zunehmendem Alter, einer Schädigung des Immunsystems, Gewebeschäden oder stressbedingten Faktoren zuzunehmen.Der Mechanismus der Zellalterung wurde als pathogener Faktor altersbedingter Krankheiten wie Arthrose, Osteoporose und Bandscheibendegeneration identifiziert.Eine Vielzahl von Reizen kann die Zellalterung beschleunigen.Als Reaktion darauf sezerniert der seneszenzbezogene sekretorische Phänotyp (SASP) hohe Konzentrationen an Proteinzellen und Zytokinen.Dieser spezielle Phänotyp hängt mit alternden Zellen zusammen, in denen sie große Mengen an entzündlichen Zytokinen (wie IL-1, IL-6, IL-8), Wachstumsfaktoren (wie TGF-β, HGF, VEGF, PDGF) absondern. MMP und Cathepsin.Im Vergleich zu jungen Menschen nimmt die SAPS nachweislich mit zunehmendem Alter zu, da der Steady-State-Prozess zerstört wird, was zu einer Zellalterung und einer verminderten Regenerationsfähigkeit führt.Insbesondere bei Gelenkerkrankungen und Erkrankungen der Skelettmuskulatur.In diesem Zusammenhang wird die Immunalterung als signifikante Veränderung im Sekretionsspektrum von Immunzellen angesehen, was darauf hindeutet, dass die Konzentration von TNF-a, IL-6 und/oder Il-1b ansteigt, was zu einer leichten chronischen Entzündung führt.Es ist erwähnenswert, dass die Dysfunktion von Stammzellen auch mit nichtzellulären autonomen Mechanismen zusammenhängt, wie z. B. alternden Zellen, insbesondere der Produktion entzündungsfördernder und antiregenerativer Faktoren durch SASP.
Im Gegenteil, SASP kann auch die Zellplastizität und die Neuprogrammierung benachbarter Zellen stimulieren.Darüber hinaus kann SASP die Kommunikation mit verschiedenen Immunmediatoren organisieren und Immunzellen aktivieren, um die Beseitigung alternder Zellen zu fördern.Das Verständnis der Rolle und Funktion alternder Zellen wird zur Heilung und Gewebeumgestaltung von MSK-Muskeln und chronischen Wunden beitragen.
Es ist bemerkenswert, dass Ritcka et al.Es wurde eine umfangreiche Studie durchgeführt, bei der die wichtigste und vorteilhafte Rolle von SASP bei der Förderung der Zellplastizität und der Geweberegeneration entdeckt und das Konzept der vorübergehenden Behandlung alternder Zellen eingeführt wurde.Sie erwähnten vorsichtig, dass das Altern vor allem ein wohltuender und regenerativer Prozess sei.
Zellalterung und Potenzial von PRP
Da die Anzahl der Stammzellen abnimmt, beeinträchtigt der Alterungsprozess die Leistungsfähigkeit der Stammzellen.Auch beim Menschen nehmen die Stammzelleigenschaften (wie Trockenheit, Proliferation und Differenzierung) mit zunehmendem Alter ab.Wang und Nirmala berichteten, dass das Altern die Eigenschaften von Sehnenzellstammzellen und die Anzahl der Wachstumsfaktorrezeptoren verringern würde.Eine Tierstudie zeigte, dass die PDGF-Konzentration bei jungen Pferden hoch war.Sie kamen zu dem Schluss, dass der Anstieg der Anzahl der GF-Rezeptoren und der GF-Anzahl bei jungen Personen möglicherweise eine bessere zelluläre Reaktion auf die PRP-Behandlung hervorruft als bei älteren Personen.Diese Ergebnisse zeigen, warum die PRP-Behandlung bei älteren Patienten mit weniger Stammzellen und „schlechter Qualität“ möglicherweise weniger wirksam oder sogar unwirksam ist.Es ist erwiesen, dass der Alterungsprozess des alternden Knorpels nach der PRP-Injektion umgekehrt wird und die Ruhezeit der Chondrozyten verlängert wird.Jia et al.Es wird zur Untersuchung der dermalen Fibroblasten von Mäusen in vitro durch Lichtalterung mit und ohne PRP-Behandlung verwendet, um den Mechanismus der PGF-Gegenwirkung in diesem Modell zu klären.Die PRP-Gruppe zeigte eine direkte Wirkung auf die extrazelluläre Matrix, erhöhte Kollagen Typ I und verringerte die Synthese von Metalloproteinasen, was darauf hindeutet, dass PRP der Zellalterung und auch bei degenerativer MSK-Erkrankung entgegenwirken kann.
In einer anderen Studie wurde PRP verwendet, um gealterte Knochenmarkstammzellen von gealterten Mäusen zu sammeln.Es wurde festgestellt, dass PRP eine Vielzahl von Stammzellfunktionen nach dem Altern wiederherstellen kann, wie z. B. Zellproliferation und Koloniebildung, und die mit der Zellalterung verbundenen Marker rekonstruieren kann.
Kürzlich untersuchten Oberlohr und seine Kollegen ausführlich die Rolle der Zellalterung bei der Schwächung der Muskelregeneration und bewerteten PRP und plättchenarmes Plasma (PPP) als biologische Behandlungsoptionen für die Reparatur der Skelettmuskulatur.Sie stellten sich vor, dass die PRP- oder PPP-Behandlung zur Reparatur der Skelettmuskulatur auf biologischen Faktoren basieren würde, die auf SASP-spezifische Zellmarker und andere Faktoren zugeschnitten sind, die zur Entwicklung von Fibrose führen.
Es ist vernünftig anzunehmen, dass vor der Anwendung von PRP eine gezielte Zellalterung die Regenerationseigenschaften der biologischen Behandlungswirksamkeit verbessern kann, indem lokale SASP-Faktoren reduziert werden.Es wurde vorgeschlagen, dass eine weitere Möglichkeit zur Verbesserung der Ergebnisse der PRP- und PPP-Behandlung zur Regeneration der Skelettmuskulatur darin besteht, alternde Zellen mit Alterungsfängern selektiv zu entfernen.Es besteht kein Zweifel, dass die jüngsten Forschungsergebnisse zur Wirkung von PRP auf die Zellalterung und das Altern faszinierend sind, aber sie befinden sich noch im Anfangsstadium.Daher ist es zum jetzigen Zeitpunkt unvernünftig, Vorschläge zu machen.
(Der Inhalt dieses Artikels wird nachgedruckt. Wir geben keine ausdrückliche oder stillschweigende Garantie für die Richtigkeit, Zuverlässigkeit oder Vollständigkeit des in diesem Artikel enthaltenen Inhalts und sind nicht für die Meinungen dieses Artikels verantwortlich. Bitte haben Sie Verständnis.)
Zeitpunkt der Veröffentlichung: 01.03.2023